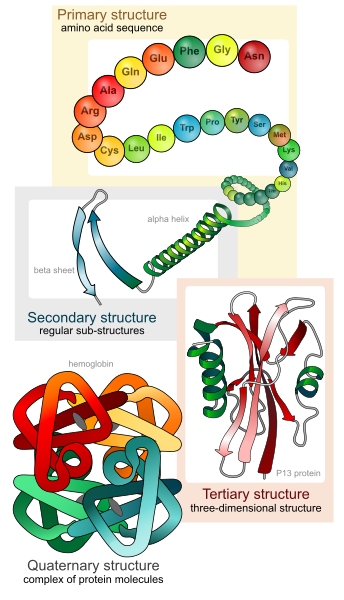
Struktur der Proteine
Primärstruktur
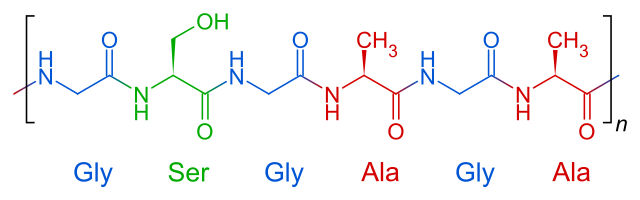
Die Primärstruktur ist die Aminosäuresequenz, also Art, Anzahl und Reihenfolge der Aminosäuren.
Sekundärstruktur
Die Sekundärstruktur erklärt die räumliche Anordnung einzelner Abschnitte. Man unterscheidet zwei Formen.
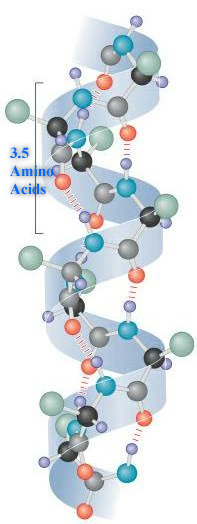
In der α-Helix ist die Peptidkette als rechtsgängige Spirale aufgebaut.
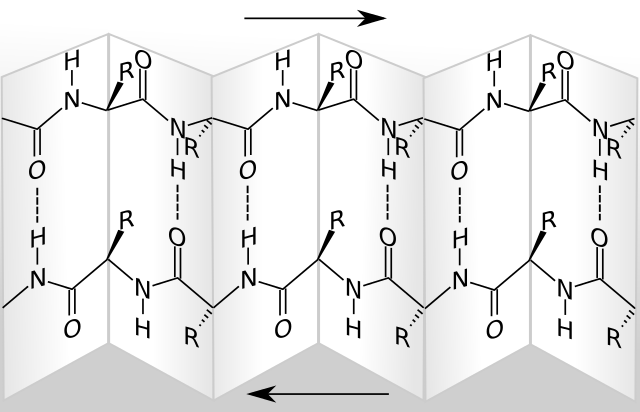
Die β-Faltblattstruktur ist eine gefaltete Fläche. Die Peptidbindungen sind parallel angeordnet und die Reste stehen abwechselnd ober- und unterhalb der Ebene.
Merke
Bei der α-Helix sind die Wasserstoffbrückenbindungen innerhalb der Helix, also innerhalb des Moleküls (intramolekular).
Die β-Faltblattstruktur hingegen bildet zwischenmolekulare (intermolekulare) Wechselwirkungen.
Tertiärstruktur
Die Tertiärstruktur beschreibt die komplette räumliche Struktur.
Man findet zerknäulte und ungeordnete Bereiche, aber einzelne Abschnitte liegen auch als α-Helix oder β-Faltblattstruktur vor.
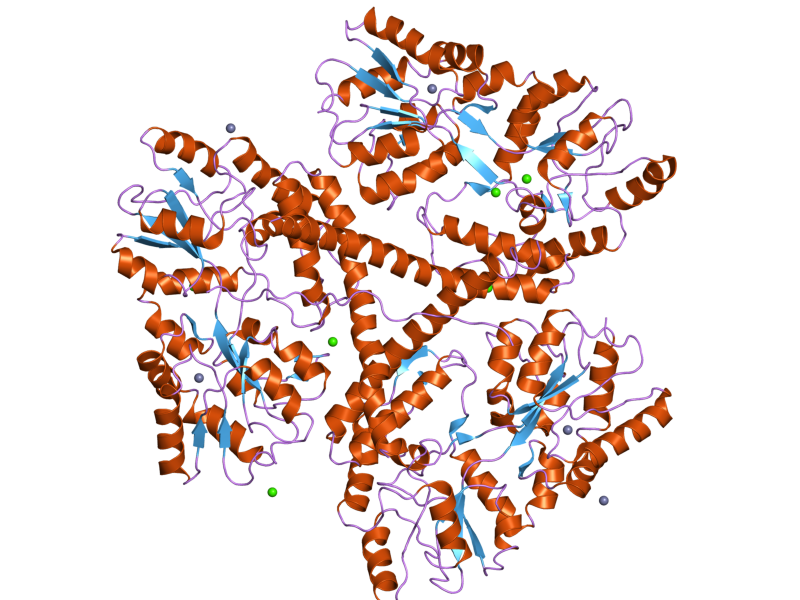
Merke
- Wasserstoffbrücken zw. polaren Seitenketten
- Van-der-Waals-Wechselwirkungen zw. unpolaren Seitenketten
- Ionenbindungen zw. Ammonium- und Carboxylatgruppen
- Disulfidbrücken (S-S-Elektronenpaarbindungen) durch Oxidation zweier Cystein-Reste
Quartiärstruktur
Proteine, die aus mehreren Polypeptidketten bestehen, haben eine Quartiärstruktur. Die Raumstruktur entspricht dabei stark jener der Tertiärstruktur.
Die gesamte Struktur zusammengefasst: