Chromophor
In Molekülen mit konjugierten C=C-Doppelbindungen sind die Elektronen delokalisiert.
i
Info
Von Delokalisierung oder von einem π-Elektronensystem spricht man, wenn Elektronen nicht genau lokalisierbar, sondern verteilt sind.
Zur Beschreibung nutzt man dann mehrere mesomere Grenzstrukturen.
Zur Beschreibung nutzt man dann mehrere mesomere Grenzstrukturen.
Die Farbigkeit hängt von ebenjener Delokalisierung ab, die auf konjugierten C=C-Doppelbindungen basiert.
Deshalb werden Atomgruppen mit solchen Mehrfachbindungen als Chromophore bezeichnet.
!
Merke
Chromophore sind Atomgruppen mit Mehrfachbindungen, die im Wechsel mit Einfachbindungen auftreten (konjugiert) und Licht im sichtbaren Bereich absorbieren.
Beispiel
Hier ist das Chromophor des Farbstoffs β-Carotin rot markiert.
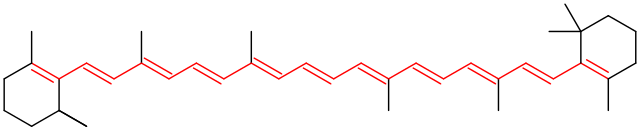
i
Hintergrund
Delokalisierte Elektronen lassen sich leicht anregen und absorbieren deshalb energiearme Strahlung.
Je größer das konjugierte π-Elektronensystem ist, desto stärker liegt die Absorption im sichtbaren Bereich.
Das erklärt auch, warum Stoffe ab 8 konjugierten C=C-Doppelbindungen farbig sind.
Je größer das konjugierte π-Elektronensystem ist, desto stärker liegt die Absorption im sichtbaren Bereich.
Das erklärt auch, warum Stoffe ab 8 konjugierten C=C-Doppelbindungen farbig sind.
Funktionelle Gruppen (Auxochrome und Antiauxochrome) können ebenfalls eine Verschiebung in den sichtbaren Bereich bewirken (bathochromer Effekt). Dadurch werden manchmal auch weniger konjugierte Doppelbindungen benötigt.
