Isotope
Atome eines Elements mit gleicher Protonenzahl aber unterschiedlicher Anzahl an Neutronen sind Isotope.
Merken
Dementsprechend haben Isotope auch die gleiche Kernladungszahl (Ordnungszahl), aber unterschiedliche Massenzahlen.
Tipp
Bei der angegebenen Massenzahl im Periodensystem handelt es sich also nur um die durchschnittliche Masse.
Um Isotope zu kennzeichnen, gibt man vor dem Elementsymbol die Massenzahl (oben) und die Kernladungszahl (unten) an.
Beispiel
Zwei Isotope von Chlor wären:
${}_{17}^{35}\rm{Cl}$ (Chlor-35) und ${}_{17}^{37}\rm{Cl}$ (Chlor-37)
Wasserstoff
Auch bei Wasserstoff gibt es 3 Isotope mit eigenen Namen.
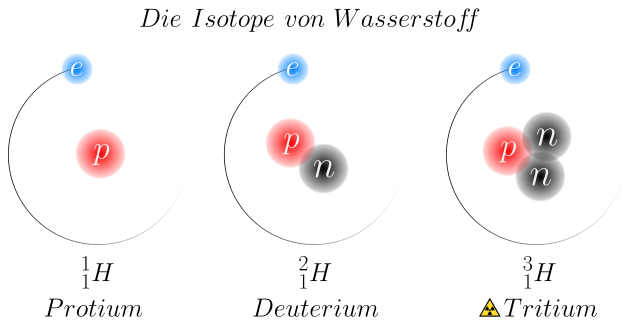
von Johannes Schneider, via Wikimedia Commons [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)]
In natürlich vorkommendem Wasserstoff ist nur ein sehr kleiner Teil Deuterium und Tritium enthalten.
Isotopengemische
Fast alle Elemente sind Isotopengemische. Nur etwa 20 Elemente bestehen aus einem einzigen Isotop. Beispiele wären
